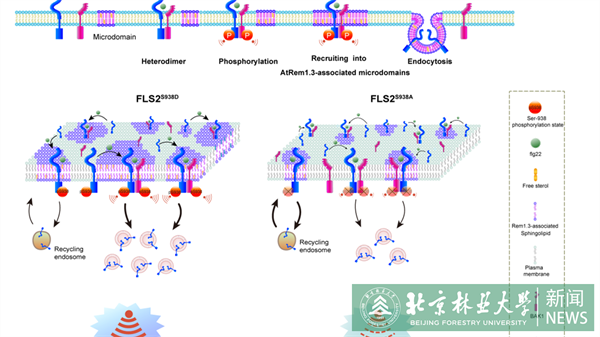
细胞膜上受体激酶 (RKs) 的磷酸化修饰在植物先天免疫反应中扮演关键角色。拟南芥Flagellin-sensing 2 (FLS2) 作为典型的RK,能识别鞭毛蛋白N端22 个氨基酸的保守区域 (flg22),从而启动植物第一道防御反应途径。前人研究已鉴定出FLS2的多个磷酸化位点,并发现Serine-938磷酸化位点在FLS2的功能调控中发挥重要作用。虽然Serine-938磷酸化位点的重要性已得到证实,但是该位点如何通过调节FLS2的时空分布特性进而影响其免疫反应的具体机制,目前仍不清楚。

近日,北京林业大学林金星教授团队在eLife发表了题为“Single-molecule analysis unveils the phosphorylation of FLS2 regulates its spatiotemporal dynamics and immunity”的研究论文。该研究运用了活细胞内蛋白分子的标记和实时动态观察技术,深入探索了磷酸化对细胞质膜上FLS2蛋白的动态性质、寡聚化状态、胞吞及其调控机制的影响。研究团队通过精密的实验设计,揭示了磷酸化修饰在调控FLS2与BAK1异源二聚体进入膜筏微区过程中的关键作用,进而影响植物免疫的新机制。这一发现不仅丰富了我们对植物免疫调控网络的认识,也为未来相关领域的研究提供了新的思路和方向。
为了阐明FLS2的Serine-938磷酸化位点在调控免疫应答中的具体作用机制,本研究选取了FLS2去磷酸化和磷酸化的转基因拟南芥植株为研究对象,通过单颗粒追踪技术,并辅以降维聚类UMAP技术,发现Serine-938磷酸化位点的状态显著影响flg22诱导的FLS2扩散动力学和停留时间。此外,借助荧光共振能量转移-荧光寿命显微成像 (FRET-FLIM) 技术、Tesseler技术、单分子蛋白接近指数 (smPPI) 和皮尔森共定位系数分析等先进技术,发现Serine-938磷酸化位点并未影响激活的FLS2与BAK1的异源寡聚化过程,却显著影响FLS2与AtRem1.3的共定位程度,这一发现不仅证明了FLS2的磷酸化发生在FLS2/BAK1异源二聚体形成之后,还揭示了Serine-938磷酸化位点在促进FLS2/BAK1高效分选至AtRem1.3相关膜微域中的关键作用。
细胞膜蛋白的胞吞作用在细胞对外界环境胁迫信号进行响应中扮演着至关重要的角色。本研究借助活细胞共聚焦显微技术和荧光相关光谱技术(FCS),并结合生化实验Western Blot方法,深入探究了Serine-938磷酸化对FLS2诱导型胞吞作用的调控机制。研究结果显示,Serine-938磷酸化不仅对FLS2的诱导型胞吞作用具有显著的促进作用,而且通过对植物免疫反应的一系列关键指标进行检测,发现这一磷酸化过程能够显著增强flg22诱导的免疫反应。
综上所述,该研究不仅揭示了FLS2的Serine-938磷酸化位点在促进FLS2/BAK1异源二聚体进入功能性AtRem1.3相关的膜微域中的关键作用,还阐明了其在激活flg22诱导的胞吞作用及免疫反应调控机制中的重要地位。这一发现为深入理解植物免疫系统的精细调控网络提供了新的视角,并有望为未来相关领域的研究与应用提供理论支持。
北京林业大学生物科学与技术学院崔亚宁副教授和博士研究生钱虹萍为该文共同第一作者,北京林业大学林金星教授为通讯作者。博士研究生徐昌文,硕士研究生尹金环、罗鹏云参与了该研究工作。团队青年教师张曦博士、李晓娟教授,以及河北农业大学的玉猛副教授,中国农业科学院的苏泊丹博士参与指导了该研究工作。该研究得到了国家自然科学基金、国家重点研究计划、北京市科技新星等项目的资助。
原文链接:https://elifesciences.org/articles/91072